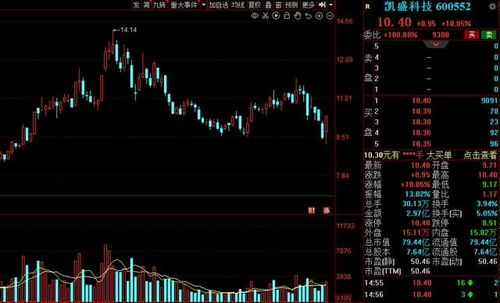
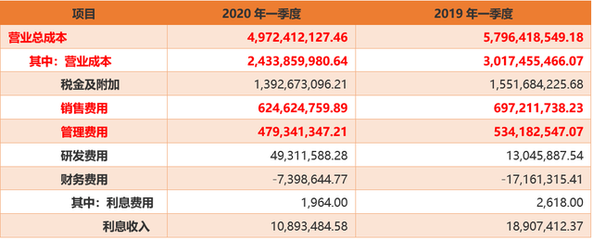
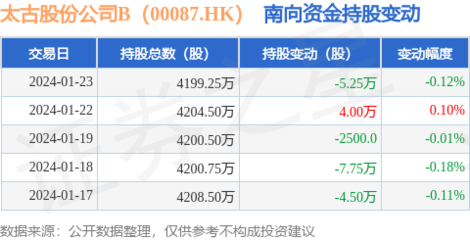
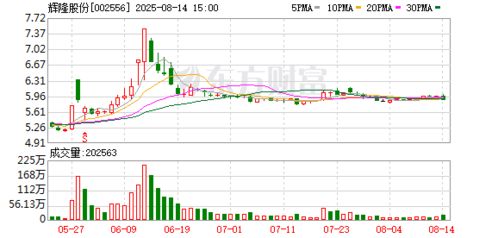
近日,福瑞达生物股份宣布已完成医用级重组Ⅲ型人源化胶原蛋白原材料在国家药品监督管理局药品审评中心的主文档备案。这一重要进展标志着该公司在生物医药材料领域的研发与合规管理方面取得了实质性突破。
医用级重组Ⅲ型人源化胶原蛋白作为一种高端生物材料,在医疗美容、创伤修复和组织工程等领域具有广泛应用前景。与传统动物源胶原蛋白相比,人源化重组胶原蛋白具有更好的生物相容性、更低的免疫原性风险,且能实现标准化生产,确保产品质量的稳定性。
完成主文档备案意味着该原材料已通过严格的技术审评,其质量、安全性和有效性得到了监管部门的认可。这将为下游医疗器械和药品生产企业使用该材料提供便利,加速相关产品的研发和上市进程。
福瑞达生物股份此次备案成功,不仅体现了公司在生物材料领域的研发实力,也为其在医用胶原蛋白市场的布局奠定了坚实基础。未来,随着人们对医疗美容和再生医学需求的不断增长,重组胶原蛋白市场有望迎来快速发展,福瑞达生物股份凭借此次备案的先发优势,有望在竞争中占据有利地位。